FUNCIONES QUIMICAS INORGÁNICAS
Se conoce como función quimica al connunto de propiedades comunes que caracterizan a una serie de sustancias, permitiendo diferenciarlas de las demás. Existen cuatro funciones quimicas inorgánicas muy reconocidas: óxidos, hidroxidos o bases, ácidos y sales.
Los Óxidos son compuestos binarios, su grupo funcional es el oxigeno, es decir, es ese átomo quien determina las caracteristicas de un óxido. Hay dos tipos de oxidos: básicos y ácidos. Al escribir la formula de un óxido, siempre el oxigeno va al final.
Óxidos básicos, también llamados óxidos metálicos, están formados por un metal y oxígeno. Ejemplos, óxido ferrico (Fe2O3), óxido de sodio (Na2O).
Óxidos ácidos, también llamados óxidos no metálicos, estan formados por un no metal y oxígeno. ejemplos, óxido
hipocloroso (Cl2O), óxido nitroso (N2O).
Hidróxidos, compuestos formados por la reacción entre un óxido básico y el agua; se caracterizan por presentar el grupo oxidrilo (OH). Ejemplo, hidróxido de sodio o sosa caustica (NaOH). Al escribir la formula de un hidróxido, siempre el grupo hidroxilo(OH) va al final.
Acidos: se caracterizan por la presencia del grupo Hidrogenión (H+); pueden ser binarios o ternarios. Los ácidos binarios se conocen como Hidrácidos, estos lo conforman el hidrogeno y cualquiera de los siguientes elementos no metálicos: cloro, bromo, yodo, fluor, azufre o selenio. Por ejemplo, el
ácido yodhídrico (HI), acido bromhidrico (HBr). Cuando se escribe la formula de un hidrácido, siempre el hidrógeno va al inicio.
Oxácidos, son acidos obtenidos por la reacción de un óxido ácido y agua. Sus moléculas están formadas por
hidrógeno, un no metal y oxígeno, en la formula quimica estas sustancias se escriben en ese mismo orden. Ejemplo, ácido clórico (HClO3); acido sulfurico (H2SO4).
Sales binarias, son compuestos formados por un hidrácido más un hidróxido. Por ejemplo, el cloruro de sodio (NaCl).
Oxisales, formadas por la reacción de un oxácido y un hidróxido, como por ejemplo el hipoclorito de sodio (NaClO).
UN MUNDO DE REACCIONES
La materia es todo lo que ocupa un lugar en el espacio, tiene masa y peso, entre otras caracteristicas. Vivimos en un mundo donde la materia esta constante transformación, constantemente observamos como el agua de rios, mares, lagos o lagunas, se evapora, para luego condensarse y regresar a nosotros en forma de lluvia.
Diariamente consumimos alimentos, los cuales en el interior del cuerpo sufren una serie de transformaciones para extraer de ellos lo que necesitamos para el cumplimiento de nuestras fnciones vitales. A diferencia del agua que se evapora, los alimentos consumidos no retornaran al entorno de la misma manera.
Los dos casos mencionadosen el parrafo anterior, son solo ejemplos sencillos para mostrar que la materia se trasnforma, en algunos casos solo cambia la forma o aparicencia fisica (el agua: se evapora, se condensa, pero...al final es agua, sus componentes no variarion). Este tipo de cambios se conocen como cambios fisicos de la materia. Como ejemplo de ellos, tenemos: quebrar un vidrio, doblar un clavo, calentar panela, congelar el agua.
Hay casos en los cuales la materia ante ciertas circuntancias (calentamiento, union con otras sustancias, exposicion al aire, etc.), cambia su composicion, es decir, sus componentes iniciales se reorganizan y originan sustancias diferentes a la que inicialmente conformaban. Este tipo de cambios se conocen como cambios quimicos.
Diariamente ocurren gran cantidad de cambios quimicos dentro y fuera de nuestro organismo. Un ejemplo de este tipo de cambios lo puedes observar cuando dejar un pedazo de hierro a la interperie, con el paso de los dias, este material se cubre de una capa de herrumbe causada por la reaccion entre el hierro y el oxigeno presente en el aire. La descomposicion de los alimentos, la combustion de la gasolina, son algunos de cambios quimicos que hacen parte de nuestra cotidianidad.
Para observar cambios fisicos y quimicos, te invito a visitar el siguiente enlace:
Los cambios quimicos reciben el nombre de reacciones quimicas, estas se definen como la transformación de una o más sustancias en otra u otras totalmente diferentes en su compoisción. En una reacción las sustancias iniciales se llaman reactivos y las finales: productos.
En la siguiente pagina, puedes observar una reaccion en la cual se produce hidrogeno y realizar una actividad virtual sobre reacciones: http://objetos.unam.mx/quimica/reaccionQuimica/index.html
Para analizar más información sobre reacciones quimicas, te invito a observar el siguiente video: https://www.youtube.com/watch?v=6xfW55f9iMY
¿QUÉ ES UNA REACCIÓN QUÍMICA?
Los cambios químicos involucran una transformación química, donde se forman nuevas sustancias que presentan propiedades diferentes a las sustancias iniciales. Una transformación química produce una reacción química. Esta es el proceso en el cual una o más sustancias iniciales (llamadas reactivos) se transforman en otras sustancias diferentes (llamadas productos).
Las reacciones químicas son una parte integral de la tecnología, de la cultura, y de hecho de la vida misma. La quema de combustibles, la fundición de hierro, la fabricación de vidrio, cerámica, cerveza, y la elaboración del vino y el queso, son muchos ejemplos de actividades que incorporan las reacciones químicas que se han conocido y utilizado durante miles de años.
En general, cuando se está produciendo una reacción química, se producen algunas “señales” o signos de que algo está ocurriendo; por ejemplo, en algunas reacciones químicas se forman burbujas que reflejan la formación de gas, en otras se forman precipitados (algo semisólido se va al fondo), desprendimiento de olores, liberación de energía térmica (calor), emisión de luz o cambio de coloración, entre otras manifestaciones.
Una reacción química se expresa de la siguiente manera: Reactivos --> Productos
Son ejemplos de reacciones químicas: Cuando se quema una hoja de papel.
La reacción química que explica la transformación del papel es:
a) La molécula de celulosa ((C6H10O5)n ) (papel) reacciona con el oxígeno.
b) Se transforma en cenizas y humo (agua y gas carbónico), liberando calor.
Cuando se oxida un clavo de hierro:
a) El clavo reacciona con el oxígeno del aire.
b) Se transforma en óxido férrico.
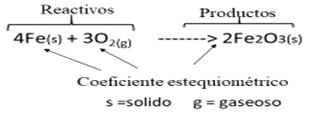
Las reacciones químicas se representan mediante ecuaciones químicas. En estas se representan lo compuestos, elementos o moléculas que actúan como reactivos y darán origen a los productos. Su representación se hace escribiendo primero los reactantes o reactivos, luego se coloca una fecha para determinar la dirección de la reacción y se escriben luego los productos. La flecha debe leerse como “se transforma en”.
La ecuación quimica brinda ciertas informaciones: formula quimica de reactivos y productos, indica el estado físico de los reactivos y productos, para ello se emplean los siguientes símbolos: (g) estado gaseoso, (s) estado Sólido, (l) estado líquido, (ac) acuoso. También aparece en ella cierta simbología: Coeficiente estequiometrico: es el número que se antepone a la formula quimica de reactivos y productos, indica la cantidad de mol o moles participantes en la reacción.
Nota: Mol es una unidad quimica que indica cantidad de sustancia.
Observa los siguientes ejemplos de ecuaciones químicas:
Ecuación quimica de la reacción que ocurre cuando se quema una hoja de papel:

Es pertinente aclarar que, si no aparece el coeficiente estequiométrico antes de la fórmula de un reactivo o un producto, se debe entender que es uno (1).
Ecuación quimica de la reacción que ocurre cuando se oxida un clavo:
Hierro + Oxígeno ------> Óxido férrico
Más información sobre reacciones y ecuaciones quimicas:
BALANCEO DE ECUACIONES
En una reaccion qimica los atomos que hacen parte de los reactivos se reacomodan para formar los productos, por ejemplo: H2 + O2 ---> H2O
En una reaccion quimica la masa de los reactivos debe ser igual a la masa de los productos, debe dar cumplimiento a la ley de conservación de la masa. Enterate en que consiste esta ley, observando el siguiente video: https://www.youtube.com/watch?v=a2MbL3C25xY
Balancear una ecuación consiste en igualar la cantidad de átomos, iones o moléculas de cada clase participantes en reactivos y productos, con la finalidad de dar cumplimiento a la ley de conservacion de la masa.
¿Cómo se balancea una ecuación? Observa:
RECORDAR PARA LA PRESENTACIÓN DE LAS PRUEBAS ICFES
A continuación te presento una síntesis de información básica para la presentación de pruebas ICFES. Una vez repases esta información dirígete a la sección "PARA HACER" y desarrolla la actividad N°5.
Se denomina gas al estado de agregación de la materia compuesto principalmente por moléculas muy debilmente unidas, que se expanden con facilidad y con poca fuerza de atracción entre ellas.













Me llama mucho la atención el tema de las reacciones Porque primeramente es un tema que quería abordar hace rato (para hacer experimentos con diferentes fórmulas) me gustó mucho haber leído como se forman las reacciones químicas y como se hace la ecuación.
ResponderBorrar